Notre équipe s’intéresse au vieillissement moléculaire des macromolécules matricielles (en particulier collagènes et élastine) et à son rôle dans le développement des pathologies vasculaires associées au vieillissement chronologique ou accéléré (diabète sucré, insuffisance rénale chronique). Le vieillissement moléculaire se définit comme les altérations que subissent les protéines au cours de leur vie biologique. Ces altérations sont de deux types, soit des réactions d’addition (par exemple oxydation, glycation, carbamylation) soit des réactions de clivage (protéolytique ou non). Nous avons montré dans des travaux antérieurs que les peptides dérivés de l’élastine (PDE) participent aux complications vasculaires et métaboliques associées au vieillissement et que le processus de carbamylation, correspondant à la fixation non enzymatique de cyanate issu de la dégradation spontanée de l’urée sur les groupements aminés des protéines, est fondamentalement impliqué dans le vieillissement matriciel et les conséquences physiopathologiques associées. Notre projet de recherche est structuré en 3 axes complémentaires :
Axe 1 : Caractérisation moléculaire et cellulaire du vieillissement de la matrice vasculaire
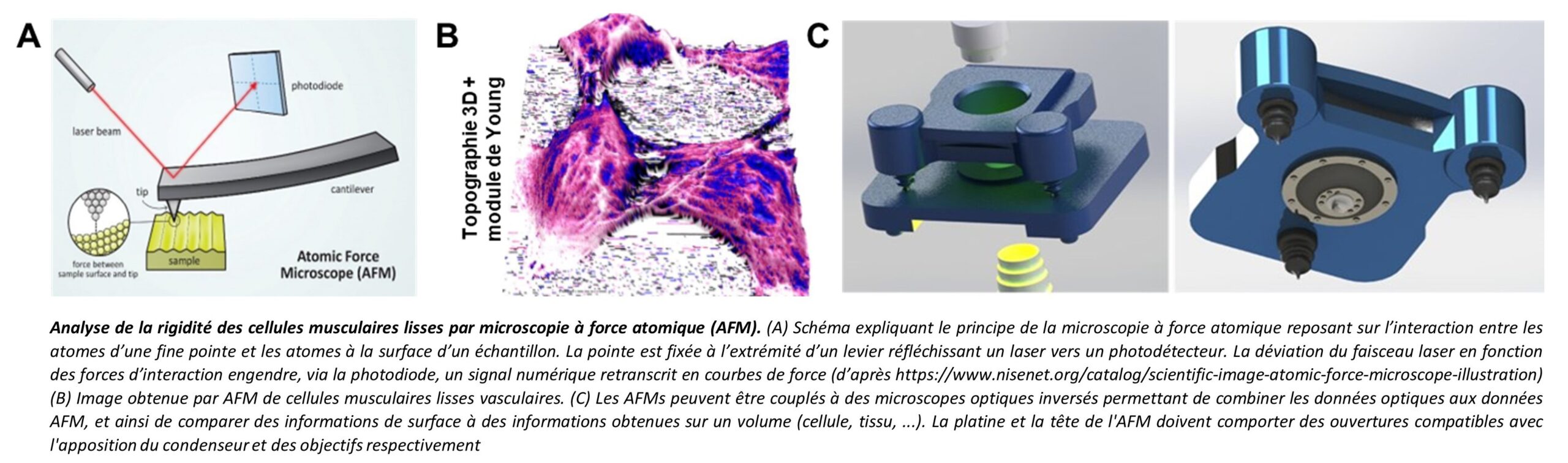
Les protéines matricielles présentent la particularité d’avoir des demi-vies longues (collagène : 20 ans / élastine : 70 ans) et sont donc très exposées au vieillissement moléculaire. Les propriétés physiques de la MEC, notamment sa densité, sa rigidité et le vieillissement de ses composants influencent le comportement des cellules à son contact. Ainsi, l’objectif de cet axe est d’analyser la modulation phénotypique des cellules musculaires lisses vasculaires (CMLv) au contact de matrices de collagène de type I et d’élastine modifiées par carbamylation et de différents degrés de rigidité. En parallèle, cet axe sera également consacré à la caractérisation des interactions fibres élastiques/adipocytes par l’identification des facteurs et voies de signalisation responsables de la production d’élastase par l’adipocyte. Les approches méthodologiques permettant de traiter ces différentes questions incluent l’association de techniques biochimiques et d’imagerie traditionnelles à des approches biophysiques plus récentes comme l’analyse de la rigidité des CMLv par microscopie à force atomique (AFM).
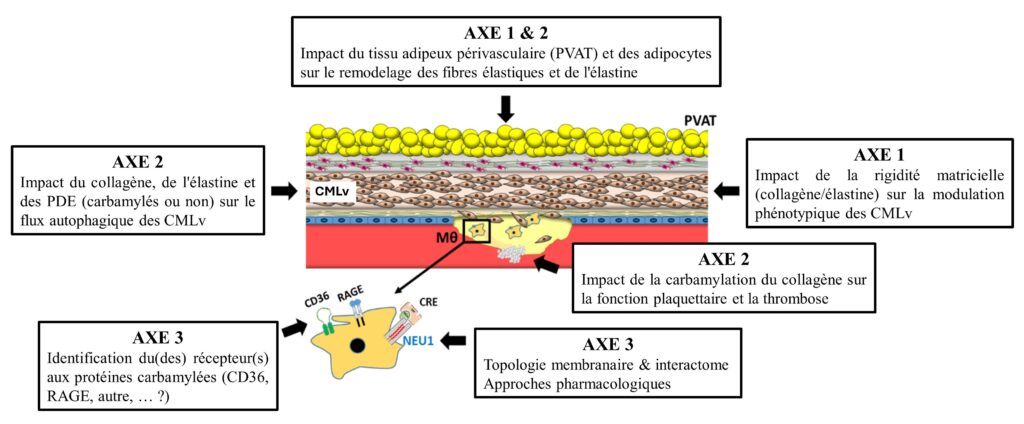
Axe 2 : Conséquences physiopathologiques du vieillissement de la matrice vasculaire
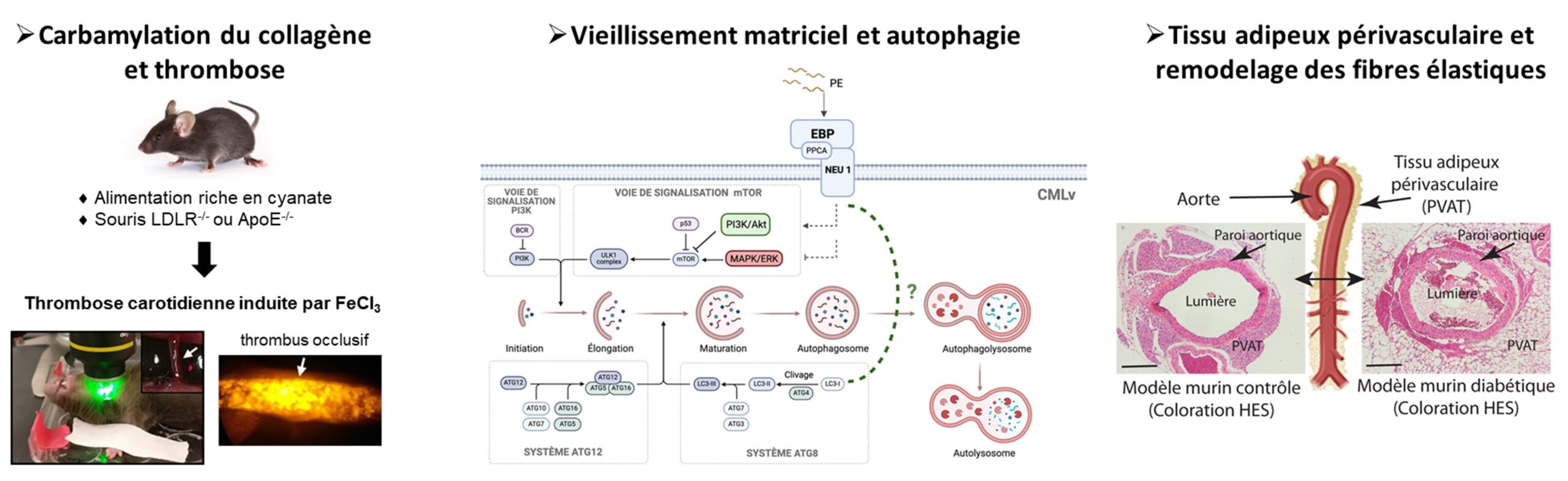
Le vieillissement des protéines matricielles a un retentissement au niveau moléculaire mais également au niveau tissulaire. Cet axe vise à analyser les conséquences physiopathologiques de ce vieillissement matriciel dans diverses situations caractérisées par un vieillissement accéléré du système vasculaire. Il a pour but d’étudier (i) l’impact de la carbamylation du collagène sur la fonction plaquettaire, l’hémostase et la thrombose artérielle, (ii) le rôle joué par le vieillissement de la MEC dans la régulation du processus autophagique artériel au niveau des CMLv, essentiel au maintien de l’homéostasie tissulaire, ainsi qu’à (iii) celui du tissu adipeux périvasculaire dans le processus de remodelage de la MEC vasculaire, à travers l’utilisation de différents modèles cellulaires et animaux adaptés.
Axe 3 : Récepteurs, signalisation et approches pharmacologiques
Outre les défauts mécaniques qu’il induit, le vieillissement matriciel peut également déréguler le fonctionnement cellulaire par l’intermédiaire de différents récepteurs et ainsi participer aux altérations fonctionnelles des vaisseaux. Nos travaux antérieurs ont montré que le complexe récepteur de l’élastine (CRE), via l’activité catalytique de sa sous-unité neuraminidase 1 (NEU1), joue un rôle prédominant dans les effets délétères des PDE, plaçant cette sialidase comme une cible pharmacologique de premier choix. Cet axe vise à (i) mieux comprendre la topologie membranaire de NEU1 et son assemblage au sein du CRE, (ii) identifier son interactome membranaire et donc les récepteurs membranaires modulables par désialylation par NEU1 et le CRE, et (iii) développer des stratégies pharmacologiques innovantes visant à inhiber la dimérisation de NEU1 et son activité catalytique (interférence peptidique, synthèse de nouveaux analogues de l’inhibiteur de sialidase DANA, purification de composés naturels bioactifs issus d’agro-ressources). Par ailleurs, afin de mieux comprendre les mécanismes cellulaires et moléculaires médiés par les produits de carbamylation et leur rôle dans le remodelage de la paroi vasculaire, cet axe vise également à identifier le(s) récepteur(s) des protéines carbamylées à partir de stratégies de purification traditionnelles et ciblées.